01. Em um experimento, preparou-se uma solução aquosa com uma quantidade excessiva de um soluto sólido. Após um período de repouso, observou-se a formação de um depósito cristalino no fundo do recipiente.
Para recuperar todo o sólido inicialmente adicionado, é necessário
(A) aquecer e filtrar a solução.
(B) deixar a solução decantar por um período mais longo.
(C) evaporar totalmente o solvente.
(D) resfriar e centrifugar a solução.
(E) adicionar à solução inicial outro solvente no qual o soluto seja insolúvel.
02. A coluna da esquerda, abaixo, apresenta cinco diferentes pares de espécies químicas; a da direita, a caracterização de quatro desses pares.
Associe adequadamente a coluna da direita à da esquerda.
A sequencia correta de preenchimento dos parênteses, de cima para baixo, é
(A) 2 - 1 - 4 - 5.
(B) 3 - 2 - 4 - 1.
(C) 3 - 5 - 1 - 2.
(D) 4 - 1 - 3 - 5.
(E) 4 - 3 - 2 - 1.
03. A tabela abaixo apresenta os valores de raio atômico, de raio íônico e da primeira energia de ionização para dois elementos químicos, I e II.
De acordo com esses dados, os elementos I e II podem ser, respectivamente,
(A) berílio e iodo.
(B) cálcio e magnésio.
(C) enxofre e cálcio.
(D) iodo e enxofre.
(E) magnésio e oxigênio.
04. Considere as afirmações abaixo, a respeito da estrutura eletrônica e da geometria do íon carbonato, CO32 -:
I - Este íon apresenta 24 elétrons de valência.
II - Sua geometria é trigonal plana.
III - Seu átomo central apresenta um par de elétrons não-ligante.
Quais estão corretas, de acordo com a Teoria da repulsão dos pares de elétrons da camada de valência?
(A) Apenas I.
(B) Apenas II.
(C) Apenas III.
(D) Apenas I e II.
(E) Apenas II e III.
05. A coluna da esquerda, abaixo, apresenta quatro tipos de substâncias sólidas; a da direita, cinco exemplos dessas substâncias.
Associe adequadamente todos os itens da coluna da direita aos respectivos itens da coluna da esquerda.
1 - metálica ( ) fluoreto de sódio
2 - iônica ( ) sílica
3 - molecular ( ) glicose
4 - covalente ( ) cromo
( )grafite
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
(A) 1 - 1 - 2 - 4 - 3.
(B) 2 - 1 - 4 - 3 - 1.
(C) 2 - 4 - 3 - 1 - 4.
(D) 3 - 1 - 4 - 1 - 2.
(E) 4 - 3 - 1 - 4 - 1.
06. Assinale a alternativa que preenche corretamente as lacunas do texto abaixo, na ordem em que aparecem.
Para diminuir as emissões causadoras da chuva ácida, é importante remover o enxofre presente nos combustíveis derivados de petróleo antes de sua comercialização.
Um dos processos utilizados para a remoção do enxofre do gás natural e de derivados de petróleo é a hidrodessulfurização catalítica, conforme a seguinte reação:
C2H5SH + H2  C2H6 + H2S
C2H6 + H2S
 C2H6 + H2S
C2H6 + H2S
Etanotiol
É correto afirmar que o tratamento de 5,00 kg de etanotiol .......... , aproximadamente, .......... de .......... .
(A) consome - 161 g - H2.
(B) produz - 242 g - C2H6.
(C) consome - 322 g - H2.
(D) produz - 1956 g - H2S.
(E) produz - 2500 g - C2H6.
07. Em uma embalagem de sal de cozinha consta a seguinte informação:
Cada 1 g contém
355 mg de sódio
Considerando-se que todo sódio provém do cloreto de sódio, o teor de cloreto de sódio nessa amostra de sal, é, aproximadamente,
(A) 10%.
(B) 23%.
(C) 39%.
(D) 58%.
(E) 90%.
08. Uma solução aquosa, levemente ácida, é preparada com concentração adequada de uma substância X. Essa solução pode ser utilizada como colírio.
Com base nessas informações, é correto afirmar que a substância X e sua solução aquosa podem ser, respectivamente,
(A) hidróxido de bário e água de bárita.
(B) ácido bórico e água boricada.
(C) peróxido de hidrogênio e água oxigenada.
(D) óxido de cálcio e água de cal.
(E) ácido perclórico e água clorada.
09. Considere a seguinte sequencia de reações de formação dos compostos X, Y e Z.
As substâncias representadas por X, Y e Z são, respectivamente,
(A) Ca(OH)2, Ca2S e CaCl.
08. Uma solução aquosa, levemente ácida, é preparada com concentração adequada de uma substância X. Essa solução pode ser utilizada como colírio.
Com base nessas informações, é correto afirmar que a substância X e sua solução aquosa podem ser, respectivamente,
(A) hidróxido de bário e água de bárita.
(B) ácido bórico e água boricada.
(C) peróxido de hidrogênio e água oxigenada.
(D) óxido de cálcio e água de cal.
(E) ácido perclórico e água clorada.
09. Considere a seguinte sequencia de reações de formação dos compostos X, Y e Z.
As substâncias representadas por X, Y e Z são, respectivamente,
(A) Ca(OH)2, Ca2S e CaCl.
(B) CaO2, CaS2 e CaCl2.
(C) CaOH, CaS e CaCl.
(D) CaO2, Ca2S e Ca2Cl.
(E) Ca(OH)2, CaS e CaCl2.
09. Nos compostos orgânicos, além do carbono e do hidrogênio, é muito frequente a presença do oxigênio.
Assinale a alternativa em que os três compostos apresentam oxigênio.
(A) formaldeído, ácido acético, cloreto de etila.
(B) trinitrotoluento, etanol, fenilamina.
(C) ácido fórmico, butanol-2, propanona.
(D) isooctano, metanol, metóxi-etano.
(E) acetato de isobutila, metil-benzeno, hexeno-2.
10. O nome oficial do composto vulgarmente conhecido como ecstasy é N-metil (3,4-metilenodioxifenil) propan-2-amina. Sua estrutura molecular está representada abaixo.
Considere as seguintes afirmações a respeito desse composto.
I - Sua fórmula molecular é C11H15NO2.
II - Sua molécula apresenta um carbono quiral.
III - Sua molécula apresenta cadeia homogênea, mista, ramificada.
Quais estão corretas?
(A) Apenas I.
(B) Apenas I e II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
12. Considere as seguintes estruturas de dois compostos orgânicos, I e II.
A análise dessas estruturas permite concluir que
(A) ambos os compostos apresentam hidroxilas alcoólicas.
(B) o composto I apresenta as funções álcool e éster.
(C) os compostos são isômeros de função.
(D) o composto II apresenta as funções fenol, éter e ácido carboxílico.
(E) ambos os compostos devem ser insolúveis em água, pois são compostos com alto peso molecular.
13. Na obtenção do vinagre de vinho, o etanol reage com o O2 do ar e transforma-se em ácido acético, conforme representado abaixo.
etanol ácido acético
Nessa reação, a geometria dos ligantes em torno do átomo de carbono do grupo funcional sogre alteração de
(A) tetraédrica para trigonal plana.
(B) trigonal plana para tetraédrica.
(C) tetraédrica para piramidal.
(D) linear para trigonal plana.
(E) linear para tetraédrica.
14. As proteínas são polímeros naturais formados através de ligações peptídicas que se estabelecem quando o grupo amino de um aminoácido reage com o grupo carboxila de outro.
Considere a estrutura primária das proteínas, representada abaixo.
onde R1, R2 = H ou substituintes.
Com base nessa estrutura, conclui-se que as proteínas são
(A) poliacrilonitrilas.
(B) poliamidas.
(C) poliésteres.
(D) policarbonatos.
(E) polissacarídios.
15. Uma solução aquosa apresenta 16% em massa de sacarose (C12H22O11). Se fosse possível fazer um "retrato" microscópico dessa solução, a proporção de moléculas de sacarose para moléculas de água seria de aproximadamente
(A) 1:1.
(B) 1:7.
(C) 1:10.
(D) 1:100.
(E) 1:700.
16. Um experimento é realizado em duas etapas.
Etapa 1: A 200 mL de água destilada contidos em um copo são adicionadas quantidades crescentes de NaCl. Essa mistura é agitada intensa e vigorosamente, até que se observe a precipitação de cristais de NaCl que não mais solubilizam.
Etapa 2: À mistura obtida na Etapa 1 são acrescentados alguns cristais de KMnO4. Após algum tempo, observa-se que a fase líquida adquire uma coloração violácea característica do permanganato de potássio.
A análise desse experimento permite concluir que
(A) a fase líquida obtida ao final da Etapa 2 é uma solução supersaturada.
(B) o NaCl e KMnO4 devem apresentar os mesmos valores de coeficiente de solubilidade.
(C) a solubilização do KMnO4 na Etapa 2 só foi possível porque a solução líquida obtida na Etapa 1 estava insaturada.
(D) a solução líquida obtida na Etapa 1, embora esteja saturada de NaCl, ainda mantém a possibilidade de solubilizar KMnO4.
(E) a fase líquida obtida ao final da Etapa 2 não pode ser considerada uma solução, porque foram utilizados dois solutos com propriedades diferentes.
17. O sal é utilizado para provocar o derretimento de neve e de gelo nas estradas de países frios e também para conservar a carne, como no processamento do charque.
A utilização de sal nessas duas situações corresponde, respectivamente, aos seguintes efeitos coligativos:
(A) efeito crioscópico e pressão osmótica.
(B) pressão osmótica e pressão osmótica.
(C) efeito tonoscópico e efeito crioscópico.
(D) pressão osmótica e efeito tonoscópico.
(E) efeito crioscópico e efeito crioscópico.
18. A reação global da célula de combustível está representada na equação termoquímica abaixo.O
H2(g) + 1/2 O2(g) H2O(l) ΔH = -283 kJ/mol
H2O(l) ΔH = -283 kJ/mol
Sabendo-se que cada grama de água absorve 2,28 kJ de calor ao vaporizar, a entalpia de formação de um mol de água gasosa é:
(A) 2,28 kJ.
(B) 41 kJ.
(C) -41 kJ.
(D) 242 kJ.
(E) -242 kJ.
19. Assinale a alternativa que preenche corretamente as lacunas do texto abaixo, na ordem em que aparecem.
Por ser uma fonte renovável de energia, o etanol tem sido cada vez mais usado como combustível para automóveis. Os calores de formação das substâncias envolvidas na combustão do etanol são apresentados no quadro abaixo.
Sabendo-se que, a 25 ºC e 1 atm, um mol de um gás ocupa um volume de aproximadamente 24,4 litros, é correto afirmar que a combustão de um mol de etanol líquido irá liberar .......... kJ de energia na forma de calor e .......... litros de gás carbônico.
(A) 401,7 - 24,4
(B) 803,4 - 48,8
(C) 803,4 - 24,4
(D) 1366,8 - 48,8
(E) 1366,8 - 24,4
20. A figura abaixo representa o esquema energético de uma reação genérica reversível, processo simples realizado em uma única etapa e que pode ocorrer sem catálise (linha cheia) ou com catálise (linha tracejada).
Sobre essa reação, são feitas as seguintes afirmações.
I - A reação direta é endotérmica.
II - A reação inversa é mais rápida na presença de catalisador.
III - O rendimento da reação direta é aumentado com o uso do catalisador.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e II.
(D) Apenas II e III.
(E) I, II e III.
21. A reação NO2(g) + CO(g) CO2(g) + NO(g) possui uma lei cinética v = [NO2]2.
CO2(g) + NO(g) possui uma lei cinética v = [NO2]2.
Considere o quadro abaixo, que apresenta os dados relativos a situações experimentais com essa reação.
A análise desses dados permite determinar que a constante de velocidade k, em L mol-1 min-1, e a velocidade v2 em mol L-1 min-1, são, respectivamente,
(A) 0,1 e 0,001.
(B) 0,1 e 0,002.
(C) 0,1 e 0,004.
(D) 10 e 0,002.
(E) 10 e 0,004.
22. Uma solução de cor violeta obtida pela fervura das folhas de repolho roxo pode ser utilizada como um indicador ácido-base. Em soluções com pH menor que 6, esse indicador adquire coloração vermelha; em soluções com pH maior que 9, ele adquire coloração verde.
Assinale a alternativa que apresenta corretamente as cores que as soluções aquosas de NH4Cl, Na2CO3 e CaSO4 adquirem na presença desse indicador.
(A)
(B)
(C)
(D)
(E)
23. A primeira etapa da obtenção industrial de ácido nítrico corresponde à reação entre amônia e oxigênio, na presença de catalisador, como mostra o equilíbrio químico abaixo.
Supondo-se que essa reação esteja ocorrendo em sistema fechado, é correto firmar que
(A) o aumento da quantidade de catalisador favorece a formação de NO.
(B) o aumento da pressão total sobre o sistema não altera o valor de kp no novo equilíbrio.
(C) a retirada de H2O(g) implica a diminuição do valor de kp.
(D) a diminuição da temperatura do sistema não altera o rendimento da reação.
(E) a diminuição do volume do sistema não altera o rendimento da reação.
24. Veículos especiais utilizam uma mistura combustível formada por alumínio em pó, perclorato de amônio e óxido de ferro III. Durante a decolagem de um ônibus espacial, uma reação que ocorre é a seguinte.
Considere as afirmações abaixo, a respeito desse processo.
I - O alumínio metálico é um agente redutor.
II - A reação apresenta dois agentes oxidantes.
III - O nitrogênio do NH4ClO4 sofre oxidação a NO.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
25. Considere os seguintes dados eletroquímicos.
Ag+(aq) + e- Ag(s) e° = + 0,80 V
Ag(s) e° = + 0,80 V
Cu2+(aq) + 2e- Cu(s) e° = + 0,34 V
Cu(s) e° = + 0,34 V
Um estudante realizou Experimentos mergulhando placas em tubos de ensaio contendo diferentes soluções aquosas, como indicado no quadro abaixo.
09. Nos compostos orgânicos, além do carbono e do hidrogênio, é muito frequente a presença do oxigênio.
Assinale a alternativa em que os três compostos apresentam oxigênio.
(A) formaldeído, ácido acético, cloreto de etila.
(B) trinitrotoluento, etanol, fenilamina.
(C) ácido fórmico, butanol-2, propanona.
(D) isooctano, metanol, metóxi-etano.
(E) acetato de isobutila, metil-benzeno, hexeno-2.
10. O nome oficial do composto vulgarmente conhecido como ecstasy é N-metil (3,4-metilenodioxifenil) propan-2-amina. Sua estrutura molecular está representada abaixo.
Considere as seguintes afirmações a respeito desse composto.
I - Sua fórmula molecular é C11H15NO2.
II - Sua molécula apresenta um carbono quiral.
III - Sua molécula apresenta cadeia homogênea, mista, ramificada.
Quais estão corretas?
(A) Apenas I.
(B) Apenas I e II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
12. Considere as seguintes estruturas de dois compostos orgânicos, I e II.
A análise dessas estruturas permite concluir que
(A) ambos os compostos apresentam hidroxilas alcoólicas.
(B) o composto I apresenta as funções álcool e éster.
(C) os compostos são isômeros de função.
(D) o composto II apresenta as funções fenol, éter e ácido carboxílico.
(E) ambos os compostos devem ser insolúveis em água, pois são compostos com alto peso molecular.
13. Na obtenção do vinagre de vinho, o etanol reage com o O2 do ar e transforma-se em ácido acético, conforme representado abaixo.
| H3C-CH2- OH + O2 |  | H3C-COOH + H2O |
Nessa reação, a geometria dos ligantes em torno do átomo de carbono do grupo funcional sogre alteração de
(A) tetraédrica para trigonal plana.
(B) trigonal plana para tetraédrica.
(C) tetraédrica para piramidal.
(D) linear para trigonal plana.
(E) linear para tetraédrica.
14. As proteínas são polímeros naturais formados através de ligações peptídicas que se estabelecem quando o grupo amino de um aminoácido reage com o grupo carboxila de outro.
Considere a estrutura primária das proteínas, representada abaixo.
onde R1, R2 = H ou substituintes.
Com base nessa estrutura, conclui-se que as proteínas são
(A) poliacrilonitrilas.
(B) poliamidas.
(C) poliésteres.
(D) policarbonatos.
(E) polissacarídios.
15. Uma solução aquosa apresenta 16% em massa de sacarose (C12H22O11). Se fosse possível fazer um "retrato" microscópico dessa solução, a proporção de moléculas de sacarose para moléculas de água seria de aproximadamente
(A) 1:1.
(B) 1:7.
(C) 1:10.
(D) 1:100.
(E) 1:700.
16. Um experimento é realizado em duas etapas.
Etapa 1: A 200 mL de água destilada contidos em um copo são adicionadas quantidades crescentes de NaCl. Essa mistura é agitada intensa e vigorosamente, até que se observe a precipitação de cristais de NaCl que não mais solubilizam.
Etapa 2: À mistura obtida na Etapa 1 são acrescentados alguns cristais de KMnO4. Após algum tempo, observa-se que a fase líquida adquire uma coloração violácea característica do permanganato de potássio.
A análise desse experimento permite concluir que
(A) a fase líquida obtida ao final da Etapa 2 é uma solução supersaturada.
(B) o NaCl e KMnO4 devem apresentar os mesmos valores de coeficiente de solubilidade.
(C) a solubilização do KMnO4 na Etapa 2 só foi possível porque a solução líquida obtida na Etapa 1 estava insaturada.
(D) a solução líquida obtida na Etapa 1, embora esteja saturada de NaCl, ainda mantém a possibilidade de solubilizar KMnO4.
(E) a fase líquida obtida ao final da Etapa 2 não pode ser considerada uma solução, porque foram utilizados dois solutos com propriedades diferentes.
17. O sal é utilizado para provocar o derretimento de neve e de gelo nas estradas de países frios e também para conservar a carne, como no processamento do charque.
A utilização de sal nessas duas situações corresponde, respectivamente, aos seguintes efeitos coligativos:
(A) efeito crioscópico e pressão osmótica.
(B) pressão osmótica e pressão osmótica.
(C) efeito tonoscópico e efeito crioscópico.
(D) pressão osmótica e efeito tonoscópico.
(E) efeito crioscópico e efeito crioscópico.
18. A reação global da célula de combustível está representada na equação termoquímica abaixo.O
H2(g) + 1/2 O2(g)
 H2O(l) ΔH = -283 kJ/mol
H2O(l) ΔH = -283 kJ/molSabendo-se que cada grama de água absorve 2,28 kJ de calor ao vaporizar, a entalpia de formação de um mol de água gasosa é:
(A) 2,28 kJ.
(B) 41 kJ.
(C) -41 kJ.
(D) 242 kJ.
(E) -242 kJ.
19. Assinale a alternativa que preenche corretamente as lacunas do texto abaixo, na ordem em que aparecem.
Por ser uma fonte renovável de energia, o etanol tem sido cada vez mais usado como combustível para automóveis. Os calores de formação das substâncias envolvidas na combustão do etanol são apresentados no quadro abaixo.
Substância
|
DH°f (kJ/mol) a 25 °C
|
CH3CH2OH (l)
|
– 277,6
|
H2O (l)
|
– 285,8
|
CO2 (g)
|
– 393,5
|
(A) 401,7 - 24,4
(B) 803,4 - 48,8
(C) 803,4 - 24,4
(D) 1366,8 - 48,8
(E) 1366,8 - 24,4
20. A figura abaixo representa o esquema energético de uma reação genérica reversível, processo simples realizado em uma única etapa e que pode ocorrer sem catálise (linha cheia) ou com catálise (linha tracejada).
Sobre essa reação, são feitas as seguintes afirmações.
I - A reação direta é endotérmica.
II - A reação inversa é mais rápida na presença de catalisador.
III - O rendimento da reação direta é aumentado com o uso do catalisador.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e II.
(D) Apenas II e III.
(E) I, II e III.
21. A reação NO2(g) + CO(g)
 CO2(g) + NO(g) possui uma lei cinética v = [NO2]2.
CO2(g) + NO(g) possui uma lei cinética v = [NO2]2.Considere o quadro abaixo, que apresenta os dados relativos a situações experimentais com essa reação.
Experimento
|
[NO2]
inicial mol/L |
[CO]
inicial mol/L |
Velocidade inicial
mol L-1 min-1 |
1
|
0,01
|
0,02
|
0,001
|
2
|
0,02
|
0,01
|
V2
|
(A) 0,1 e 0,001.
(B) 0,1 e 0,002.
(C) 0,1 e 0,004.
(D) 10 e 0,002.
(E) 10 e 0,004.
22. Uma solução de cor violeta obtida pela fervura das folhas de repolho roxo pode ser utilizada como um indicador ácido-base. Em soluções com pH menor que 6, esse indicador adquire coloração vermelha; em soluções com pH maior que 9, ele adquire coloração verde.
Assinale a alternativa que apresenta corretamente as cores que as soluções aquosas de NH4Cl, Na2CO3 e CaSO4 adquirem na presença desse indicador.
(A)

(B)

(C)

(D)

(E)

23. A primeira etapa da obtenção industrial de ácido nítrico corresponde à reação entre amônia e oxigênio, na presença de catalisador, como mostra o equilíbrio químico abaixo.
Supondo-se que essa reação esteja ocorrendo em sistema fechado, é correto firmar que
(A) o aumento da quantidade de catalisador favorece a formação de NO.
(B) o aumento da pressão total sobre o sistema não altera o valor de kp no novo equilíbrio.
(C) a retirada de H2O(g) implica a diminuição do valor de kp.
(D) a diminuição da temperatura do sistema não altera o rendimento da reação.
(E) a diminuição do volume do sistema não altera o rendimento da reação.
24. Veículos especiais utilizam uma mistura combustível formada por alumínio em pó, perclorato de amônio e óxido de ferro III. Durante a decolagem de um ônibus espacial, uma reação que ocorre é a seguinte.
Considere as afirmações abaixo, a respeito desse processo.
I - O alumínio metálico é um agente redutor.
II - A reação apresenta dois agentes oxidantes.
III - O nitrogênio do NH4ClO4 sofre oxidação a NO.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e III.
(D) Apenas II e III.
(E) I, II e III.
25. Considere os seguintes dados eletroquímicos.
Ag+(aq) + e-
 Ag(s) e° = + 0,80 V
Ag(s) e° = + 0,80 VCu2+(aq) + 2e-
 Cu(s) e° = + 0,34 V
Cu(s) e° = + 0,34 VUm estudante realizou Experimentos mergulhando placas em tubos de ensaio contendo diferentes soluções aquosas, como indicado no quadro abaixo.
Metal
|
Solução
| |
AgNO3
|
Cu(NO3)2
| |
Ag
|
tubo 1
|
tubo 2
|
Cu
|
tubo 3
|
tubo 4
|
Com base no exposto, é correto afirmar que ocorre deposição de metal sobre a placa metálica apenas
(A) no tubo 2.
(B) no tubo 3.
(C) nos tubos 1 e 2.
(D) nos tubos 1 e 3.
(E) nos tubos 2 e 4.
Gabarito:
01.C 02.D 03.E 04.D 05.C 06.A 07.E 08.B 09.E 10.C 11.B 12.C 13.A 14.B 15.D 16.D 17.A 18.E 19.D 20.C 21.E 22.A 23.B 24.C 25.B







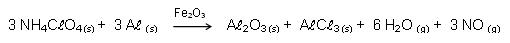
Nenhum comentário:
Postar um comentário