01. Questão dissertativa com resolução no link da questão.
02. Letra: B
(A) Errado. Essa foi uma das bases para o modelo atômico de Thomson.
(B) Certo. Pelo experimento, Rutherford presumiu que o núcleo atômico era minúsculo se com parado com o volume total que um átomo deveria possuir. Como comparação podemos dizer que um átomo tem o tamanho de uma estádio de futebol e no seu centro está o núcleo que possui o tamanho de uma bola de golfe.
(C) Errado. Essa foia a base de formulação do modelo atômico de Thomson.
(D) Errado. Essa foi a base do modelo de Sommerfeld.
(E) Errado. Essa foi uma das bases para o modelo atômico de Dalton.
03. Letra: E
As representações na notação são as seguintes:
Fe é o símbolo do elemento químico e ele é o ferro.
26 subscrito a esquerda representa o número atômico do elemento e seu número de prótons.
56 sobrescrito a direita é a massa atômica que é a soma da quantidade da soma do número de prótons e número de nêutrons no átomo. Com a variação do número de nêutrons podemos ter diferentes números de massa, que complica em diferentes isótopos do mesmo elemento.
04. Letra: B
(A) Errado. As teorias do eletromagnetismo foi um dos problemas para o modelo atômico de Rutherford e não referência para as correções feitas por Bohr.
(B) Certo. A teoria da quantização de energia foi o modelo utilizado por Bohr para tentar corrigir os problemas encontrados na teoria de como seria o átomo, proposta por Rutherford.
(C) Errado. A teoria da relatividade de Einstein não foi utilizada em nenhum momento por Bohr ou outro cientista para explicar o comportamento dos átomos.
(D) Errado. Bohr não usou nenhuma referência a uma teoria do núcleo atômico para tentar explicar porque o átomo não colapsava segundo o modelo proposto por Rutherford.
(E) Errado. A letra B é a correta.
05. Letra: A
(A) Correta. A teoria dos níveis de energia foi proposta por Bohr.
(B) Errado. Um núcleo atômico onde elétrons ficam em seu entorno é uma teoria proposta por Rutherford.
(C) Errado. O átomo como se fosse uma espécie de sistema solar com seus elétrons girando em volta do núcleo como se fosse uma espécie de modelo solar foi o tipo de modelo trazido por Rutherford.
(D) Errado. O número atômico surgiu após as definições propostas no modelo atômico de Rutherford
(E) Errado. A ideia dos isótopos deve-se a Aston.
06. Letra: D
Todas as opções formuladas na questão (I, II e III) estão corretas pois estavam presentes na teoria atômica proposta por Dalton.
07. Letra: D
I - Errado. A descoberta dos elétrons foi o que sustentou o modelo atômico de Thmson e não a radioatividade.
II - Correto.
III - Correto.
IV - Correto.
Como apenas a afirmativa I estava errada logo há 3 afirmativas corretas (II, III e IV).
II - Correto.
III - Correto.
IV - Correto.
Como apenas a afirmativa I estava errada logo há 3 afirmativas corretas (II, III e IV).
08. Letra: D
O número atômico é o mesmo número de prótons existentes no núcleo do átomo, logo o número atômico é 17.
O número de massa é a soma da quantidade de prótons e nêutrons existentes no núcleo dos átomos, com isso temos 17 + 18 = 35. O número de massa a partir dos dados fornecidos pela questão é 35.
O número de massa é a soma da quantidade de prótons e nêutrons existentes no núcleo dos átomos, com isso temos 17 + 18 = 35. O número de massa a partir dos dados fornecidos pela questão é 35.
09. Letra: D
(A) Errado. A experiência que evidenciou a existência do elétron foi a da Ampola de Crookes feita por Thomson.
(B) Errado. A descoberta dos nêutrons deve-se a experiências feitas por James Chadwick em 1932.
(C) Errado. A experiência que evidenciou a existência dos prótons foi feita muito antes, por Rutherford e Goldstein.
(D) Correto. No bombardeamento da lâmina de ouro com partículas alfa foi evidenciada a presença de um núcleo nos átomos.
(E) Errado. Os dêuteron, núcleos de deutério (um isótopo do hidrogênio) desprovidos de seu único elétron, foram evidenciados em experimentos feitos por Harold Clayton Urey, F. C. Brickwedde e G. Murphy.
(B) Errado. A descoberta dos nêutrons deve-se a experiências feitas por James Chadwick em 1932.
(C) Errado. A experiência que evidenciou a existência dos prótons foi feita muito antes, por Rutherford e Goldstein.
(D) Correto. No bombardeamento da lâmina de ouro com partículas alfa foi evidenciada a presença de um núcleo nos átomos.
(E) Errado. Os dêuteron, núcleos de deutério (um isótopo do hidrogênio) desprovidos de seu único elétron, foram evidenciados em experimentos feitos por Harold Clayton Urey, F. C. Brickwedde e G. Murphy.
10. Letra: B
Das opções apresentadas, a única que realmente pode se referir ao símbolo do elemento químico é o número de prótons, pois esse número é que está relacionado com o número atômico e, assim, ao símbolo que representa o elemento químico.
11. Letra: C
(A) Correto. Carga nuclear, caso haja dúvidas, é referente ao número de prótons no núcleo, que é o número utilizado para definir o número atômico dos elementos químicos.
(B) Correto.
(C) Errado. Contrário: O elétron passa de uma órbita mais interna para uma mais externa.
(D) Correto.
(E) Correto.
(B) Correto.
(C) Errado. Contrário: O elétron passa de uma órbita mais interna para uma mais externa.
(D) Correto.
(E) Correto.
12. Letra: D
O símbolo é a representação oficial de qualquer elemento químico, no qual terá o seu número atômico representado sempre através da quantidade de prótons em seu núcleo, onde a única coisa que pode se alterar para que ele permaneça como sendo o mesmo elemento químico é a quantidade de nêutrons em seu núcleo.
13. Letra: C
(A) Esse postulado é referente ao modelo atômico de Rutherford.
(B) Os átomos não liberam energia para efetuar o salto quântico especificado. Para fazer o sato de nível um elétron absorve energia.
(C) Este postulado pertence ao modelo atômico de Bohr.
(D) Este postulado pertence ao modelo atômico de Dalton.
(E) Este postulado pertence ao modelo atômico de Thmson.
14. Letra: E
O símbolo é a representação oficial de qualquer elemento químico, no qual terá o seu número atômico representado sempre através da quantidade de prótons em seu núcleo, onde a única coisa que pode se alterar para que ele permaneça como sendo o mesmo elemento químico é a quantidade de nêutrons em seu núcleo.
13. Letra: C
(A) Esse postulado é referente ao modelo atômico de Rutherford.
(B) Os átomos não liberam energia para efetuar o salto quântico especificado. Para fazer o sato de nível um elétron absorve energia.
(C) Este postulado pertence ao modelo atômico de Bohr.
(D) Este postulado pertence ao modelo atômico de Dalton.
(E) Este postulado pertence ao modelo atômico de Thmson.
14. Letra: E

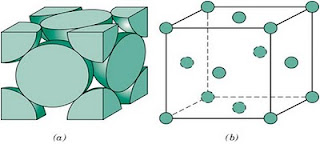
Colocando a imagem 3d e analisando os átomos que estão rodeando um outro átomo percebe-se que a quantidade é 12, logo seu número de coordenação também é 12 nesse sistema.
15. Letra: C
(A) Esse postulado é referente ao modelo atômico de Rutherford.
(B) Os átomos não liberam energia para efetuar o salto quântico especificado. Para fazer o sato de nível um elétron absorve energia.
(C) Este postulado pertence ao modelo atômico de Bohr.
(D) Este postulado pertence ao modelo atômico de Dalton.
(E) Este postulado pertence ao modelo atômico de Thmson.
15. Letra: A
Todas as características indicadas pelo aluno para cada modelo estão corretas, logo não erros.
16. Letra: B
Como os metais são diferentes e apenas a sua estrutura cristalina é igual, as densidades, os números de átomo por volume unitário, as propriedades químicas e as condutibilidades elétricas são diferentes. O único valor que eles terão equivalência será o número de coordenação, pois suas estruturas cristalinas são idênticas.
17. Letra: B
A evolução do modelo atômico se dá da seguinte forma:
1º - Átomo como partícula maciça, indivisível e indestrutível (II).
2º - Átomo como partícula maciça com carga positiva incrustada de elétrons (IV).
3º - Átomo formado por núcleo positivo com elétrons girando ao seu redor, na eletrosfera (V).
4º - Átomo como partícula descontínua com eletrosfera dividida em níveis de energia (I).
5º - Átomo como modelo probabilístico, sem precisão espacial do elétron (III).
Com isso temos que a sequência é: II - IV - V - I - III.
18. Letra: A
O K2SO4 é um uma substância formada por íons: o K+ e SO42-, logo seus nós apresentam íons.
O S possui diversas formas como o S8, mais popular, logo seus cristais são formados por moléculas e as mesmas é que são encontradas em seus nós.
O Zn é um metal e sua rede cristalina é formada exclusivamente de um arranjo complexo desse metal, logo em seus nós serão encontrados átomos.
Com essa análise temos que a sequência correta é: íons, moléculas e átomos.
19. Letra: E
(A) Errado. A maioria realmente atravessou a lâmina sem sofrer desvios de sua trajetória, mas não foram todas, logo essa afirmação não poderia corroborar com o que Rutherford presumiu.
(B) Errado. Um número muito pequeno de partículas alfa não atravessou a lâmina.
(C) Errado. As partículas alfa têm carga positiva e esse detalhe não foi o que ajudou Rutherford especular o tamanho do núcleo atômico, mas ajudou em relação a sua carga.
(D) Errado. Uma grande número de partículas atravessou a lâmina, o que ajudou a supor que os átomos possuíam um imenso espaço vazio entre os núcleos de um e outro.
(E) Correto. Pelo fato de cargas iguais se repelirem e as partículas alfa possuírem carga positiva, supos-se que o núcleo também possuía esta carga, e o fato de poucas sofrerem desvio por este detalhe e a maioria simplesmente atravessar a lâmina como se não houvesse obstáculo ajudou a indicar que o átomo possuía um núcleo muito pequeno e positivo.
20. Letra: C
De todas as alternativas apresentadas a única que Rutherford não conseguiu saber era se a densidade dos átomos era uniforme ou não. O resto todo Rutherford sabia ou previu conforme mostrado.
21. Letra: B
1º - Um sistema planetário com órbitas quantizadas foi um dos postulados feitos por Bohr ao propor o seu modelo (III).
2º - Uma esfera com carga positiva, na qual estão contidas algumas cargas negativas, foi um dos postulados apresentados por Thomson na formulação de seu modelo (IV).
3º - O sistema planetário com órbitas circulares foi um dos postulados propostos por Rutherford quando ele propôs o seu modelo (I).
4º - Uma esfera maciça e indestrutível foi a base do modelo proposto por Dalton (II).
A partir da análise do que foi apresentado, temos que a ordem correta é: III - IV - I - II.
22. Letra: C
(A) O P é o símbolo do fósforo e que tem como nome latino Phosphorus. Ar é o símbolo do argônio e que tem como nome latino Argon. Sr é o símbolo do estrôncio e que tem como nome latino Strontium.
(B) O Pm é o símbolo do promécio e que tem como nome latino Promethium. At é o símbolo do astato e que tem como nome latino Astatium. Sn é o símbolo do estanho e que tem como nome latino Stannum.
(C) O Pb é o símbolo do chumbo e que tem como nome latino Plumbum. Ag é o símbolo da prata e que tem como nome latino Argentum. Sb é o símbolo do antimônio e que tem como nome latino Seaborgium.
(D) O Pu é o símbolo do plutônio e que tem como nome latino Plutonium. Hg é o símbolo do mercúrio e que tem como nome latino Hydrargyrum. Si é o símbolo do silício e que tem como nome latino Silicium.
(E) O Po é o símbolo do polônio e que tem como nome latino Polonium. S é o símbolo do enxofre e que tem como nome latino Sulfur. Bi é o símbolo do bismuto e que tem como nome latino Bisemutum.
23. Letra: A
Na I são dadas informações referentes ao átomo A, na II nos é dado a informação de B, as quais já serão interpretadas e na III é dito que A e B são isótonos, logo, possuem a mesma quantidade de nêutrons, ou seja, ao se descobrir a quantidade de nêutrons existentes em A, se descobre o mesmo para B.
Na informação I é dado que o número de massa de A é 40 e como o número de massa é a soma da quantidade de prótons mais nêutrons podemos descobrir a quantidade de nêutron fazendo o número de massa menos a quantidade de prótons.
Outra informação dada é que o átomo possui 21 elétrons e como um átomo possui quantidades iguais de prótons e elétrons, o que mantém a sua neutralidade, sabemos, então, que o átomo A possui 21 prótons.
Com as duas últimas informações sabemos que o número de nêutrons de A é 40 - 21 = 19 nêutrons.
O número atômico de B, fornecido na informação II, é o mesmo valor da quantidade de prótons que o átomo B possui: 20.
Como já sabemos que o número de massa é a soma da quantidade de prótons mais nêutrons, e que B é isotono de A segundo a informação III, logo B possui 19 nêutrons, temos, então, que o número de massa de B é:
19 + 20 = 39, que é a resposta da questão.
24. Letra: A
Ao ser realizada a distribuição eletrônica do Césio em níveis de energia, tem-se que do nível 1 até o nível 4 sua distribuição é completa, o que nos permite afirmar que haverá 18 elétrons nos níveis 3 e 4.
Cs = 55 elétrons.
Nível:
1 - 2 elétrons.
2 - 8 elétrons.
3 - 18 elétrons.
4 - 18 elétrons.
5 - 8 elétrons.
6 - 1 elétron.
25. Letra: E
I - Thomson propôs que o átomo não era mais indivisível e indestrutível, tese que era sustentada pela descoberta da radioatividade.
II - Graças aos desvios de trajetória de poucas partículas alfa no experimento de Rutherford, o núcleo atômico, assim como sua carga positiva foram descobertos.
III - Em cima disso Bohr mostrou que os elétrons podiam mudar de níveis de energia conforme absorviam ou liberavam energia.
IV - Essa liberação de energia é que foi explicada em III e essa liberação se dá em forma de luz visível e colorida, dependendo do elemento químico, o que faz com que cada elemento tenha uma cor característica que pode ser vista na experiência da chama.
15. Letra: C
(A) Esse postulado é referente ao modelo atômico de Rutherford.
(B) Os átomos não liberam energia para efetuar o salto quântico especificado. Para fazer o sato de nível um elétron absorve energia.
(C) Este postulado pertence ao modelo atômico de Bohr.
(D) Este postulado pertence ao modelo atômico de Dalton.
(E) Este postulado pertence ao modelo atômico de Thmson.
15. Letra: A
Todas as características indicadas pelo aluno para cada modelo estão corretas, logo não erros.
16. Letra: B
Como os metais são diferentes e apenas a sua estrutura cristalina é igual, as densidades, os números de átomo por volume unitário, as propriedades químicas e as condutibilidades elétricas são diferentes. O único valor que eles terão equivalência será o número de coordenação, pois suas estruturas cristalinas são idênticas.
17. Letra: B
A evolução do modelo atômico se dá da seguinte forma:
1º - Átomo como partícula maciça, indivisível e indestrutível (II).
2º - Átomo como partícula maciça com carga positiva incrustada de elétrons (IV).
3º - Átomo formado por núcleo positivo com elétrons girando ao seu redor, na eletrosfera (V).
4º - Átomo como partícula descontínua com eletrosfera dividida em níveis de energia (I).
5º - Átomo como modelo probabilístico, sem precisão espacial do elétron (III).
Com isso temos que a sequência é: II - IV - V - I - III.
18. Letra: A
O K2SO4 é um uma substância formada por íons: o K+ e SO42-, logo seus nós apresentam íons.
O S possui diversas formas como o S8, mais popular, logo seus cristais são formados por moléculas e as mesmas é que são encontradas em seus nós.
O Zn é um metal e sua rede cristalina é formada exclusivamente de um arranjo complexo desse metal, logo em seus nós serão encontrados átomos.
Com essa análise temos que a sequência correta é: íons, moléculas e átomos.
19. Letra: E
(A) Errado. A maioria realmente atravessou a lâmina sem sofrer desvios de sua trajetória, mas não foram todas, logo essa afirmação não poderia corroborar com o que Rutherford presumiu.
(B) Errado. Um número muito pequeno de partículas alfa não atravessou a lâmina.
(C) Errado. As partículas alfa têm carga positiva e esse detalhe não foi o que ajudou Rutherford especular o tamanho do núcleo atômico, mas ajudou em relação a sua carga.
(D) Errado. Uma grande número de partículas atravessou a lâmina, o que ajudou a supor que os átomos possuíam um imenso espaço vazio entre os núcleos de um e outro.
(E) Correto. Pelo fato de cargas iguais se repelirem e as partículas alfa possuírem carga positiva, supos-se que o núcleo também possuía esta carga, e o fato de poucas sofrerem desvio por este detalhe e a maioria simplesmente atravessar a lâmina como se não houvesse obstáculo ajudou a indicar que o átomo possuía um núcleo muito pequeno e positivo.
20. Letra: C
De todas as alternativas apresentadas a única que Rutherford não conseguiu saber era se a densidade dos átomos era uniforme ou não. O resto todo Rutherford sabia ou previu conforme mostrado.
21. Letra: B
1º - Um sistema planetário com órbitas quantizadas foi um dos postulados feitos por Bohr ao propor o seu modelo (III).
2º - Uma esfera com carga positiva, na qual estão contidas algumas cargas negativas, foi um dos postulados apresentados por Thomson na formulação de seu modelo (IV).
3º - O sistema planetário com órbitas circulares foi um dos postulados propostos por Rutherford quando ele propôs o seu modelo (I).
4º - Uma esfera maciça e indestrutível foi a base do modelo proposto por Dalton (II).
A partir da análise do que foi apresentado, temos que a ordem correta é: III - IV - I - II.
22. Letra: C
(A) O P é o símbolo do fósforo e que tem como nome latino Phosphorus. Ar é o símbolo do argônio e que tem como nome latino Argon. Sr é o símbolo do estrôncio e que tem como nome latino Strontium.
(B) O Pm é o símbolo do promécio e que tem como nome latino Promethium. At é o símbolo do astato e que tem como nome latino Astatium. Sn é o símbolo do estanho e que tem como nome latino Stannum.
(C) O Pb é o símbolo do chumbo e que tem como nome latino Plumbum. Ag é o símbolo da prata e que tem como nome latino Argentum. Sb é o símbolo do antimônio e que tem como nome latino Seaborgium.
(D) O Pu é o símbolo do plutônio e que tem como nome latino Plutonium. Hg é o símbolo do mercúrio e que tem como nome latino Hydrargyrum. Si é o símbolo do silício e que tem como nome latino Silicium.
(E) O Po é o símbolo do polônio e que tem como nome latino Polonium. S é o símbolo do enxofre e que tem como nome latino Sulfur. Bi é o símbolo do bismuto e que tem como nome latino Bisemutum.
23. Letra: A
Na I são dadas informações referentes ao átomo A, na II nos é dado a informação de B, as quais já serão interpretadas e na III é dito que A e B são isótonos, logo, possuem a mesma quantidade de nêutrons, ou seja, ao se descobrir a quantidade de nêutrons existentes em A, se descobre o mesmo para B.
Na informação I é dado que o número de massa de A é 40 e como o número de massa é a soma da quantidade de prótons mais nêutrons podemos descobrir a quantidade de nêutron fazendo o número de massa menos a quantidade de prótons.
Outra informação dada é que o átomo possui 21 elétrons e como um átomo possui quantidades iguais de prótons e elétrons, o que mantém a sua neutralidade, sabemos, então, que o átomo A possui 21 prótons.
Com as duas últimas informações sabemos que o número de nêutrons de A é 40 - 21 = 19 nêutrons.
O número atômico de B, fornecido na informação II, é o mesmo valor da quantidade de prótons que o átomo B possui: 20.
Como já sabemos que o número de massa é a soma da quantidade de prótons mais nêutrons, e que B é isotono de A segundo a informação III, logo B possui 19 nêutrons, temos, então, que o número de massa de B é:
19 + 20 = 39, que é a resposta da questão.
24. Letra: A
Ao ser realizada a distribuição eletrônica do Césio em níveis de energia, tem-se que do nível 1 até o nível 4 sua distribuição é completa, o que nos permite afirmar que haverá 18 elétrons nos níveis 3 e 4.
Cs = 55 elétrons.
Nível:
1 - 2 elétrons.
2 - 8 elétrons.
3 - 18 elétrons.
4 - 18 elétrons.
5 - 8 elétrons.
6 - 1 elétron.
25. Letra: E
I - Thomson propôs que o átomo não era mais indivisível e indestrutível, tese que era sustentada pela descoberta da radioatividade.
II - Graças aos desvios de trajetória de poucas partículas alfa no experimento de Rutherford, o núcleo atômico, assim como sua carga positiva foram descobertos.
III - Em cima disso Bohr mostrou que os elétrons podiam mudar de níveis de energia conforme absorviam ou liberavam energia.
IV - Essa liberação de energia é que foi explicada em III e essa liberação se dá em forma de luz visível e colorida, dependendo do elemento químico, o que faz com que cada elemento tenha uma cor característica que pode ser vista na experiência da chama.
Nenhum comentário:
Postar um comentário