Quais estão corretas?
(A) Apenas II.
(B) Apenas I e IV.
(C) Apenas II e III.
(D) Apenas I, II e III.
(E) I, II, III e IV.
02. Considere as seguintes equações termoquímicas.
Com base nas informações acima, é possível determinar os valores de ΔH0 para as reações representadas pelas equações termoquímicas IV, V e VI abaixo.
Assinale a alternativa que apresenta, respectivamente, esses valores, em kJ.(A) +92,2 - +250 - -57,0
(B) +46,1 - -250 - -114
(C) +184,4 - -500 - +114
(D) -46,1 - -500 - +57,0
(E) -92,2 - +250 - -28,5
03. Considere as seguintes reações, na temperatura de 25ºC.
A diferença entre os efeitos térmicos, (DH)1 - (DH)2, é igual
(A) a zero.
(B) ao calor de vaporização da água.
(C) ao calor de fusão do gelo.
(D) ao calor de condensação do vapor de água.
(E) ao calor de solidificação da água.
04. Considere as seguintes equações termoquímicas.
Utilizando as equações acima, pode-se deduzir o valor de DHº para a reação de formação de radicais hidroxila, segundo a reação representada pela equação abaixo.
O valor de DHº assim obtido é de:(A) +65,8 kJ.
(B) -111,9 kJ.
(C) +104,8 kJ.
(D) -150,9 kJ.
(E) +267,9 kJ.
05. Considere as energias de ligação, em kJ.mol-1, listadas na tabela abaixo.
O valor de DHº, em kJ.mol-1, para a reação CH3=CH2 + Br2 ---> CH3CHBrCH2Br é igual a:
(A) -235.
(B) -112.
(C) zero.
(D) +112.
(E) +235.
06. Considere as seguintes equações termoquímicas.
Combinando essas equações, é possível obter o valor da entalpia padrão de formação do metanol a 25ºC. Esse valor, em kJ, é aproximadamente de:
(A) -726.
(B) -239.
(C) -47.
(D) +239.
(E) +726.
07. Considere as seguintes entalpias de formação a 25ºC, expressas em kJ.
Esses dados permitem concluir que a entalpia correspondente a combustão completa de um mol de metanol a 25ºC, expressa em kJ, é igual a:
(A) -1406.
(B) -240.
(C) -46.
(D) +46.
(E) +240.
08. Considere o diagrama abaixo, que representa equações termoquímicas genéricas.
Segundo a Lei de Hess, a relação matemática correta entre os DH é dada pela expressão:
(A) DH = DH1 + DH2 + DH3 + DH4.
(B) DH1 + DH2 = DH3 + DH4.
(C) DH1 = DH2 + DH3 + DH4.
(D) DH1 + DH2 + DH3 + DH4 = 0.
(E) DH1 + DH2 + DH3 = DH4.
09. A equação global da célula de combustível está representada na equação termoquímica abaixo.
Sabendo-se que cada grama de água absorve 2,28 kJ de calor ao vaporizar, a entalpia de formação de um mol de água gasosa é:
(A) 2,28 kJ.
(B) 41 kJ.
(C) -41 kJ.
(D) 242 kJ.
(E) -242 kJ.
10. Assinale a alternativa que preenche corretamente as lacunas do texto abaixo, na ordem em que aparecem.
Por ser uma fonte renovável de energia, o etanol tem sido cada vez mais usado como combustível para automóveis. Os calores de formação das substâncias envolvidas na combustão do etanol estão apresentados no quadro abaixo.
Sabendo-se que, a 25ºC e 1 atm, um mol de um gás ocupa um volume de aproximadamente 24,4 litros, é correto afirmar que a combustão de um mol de etanol líquido irá liberar ...... kJ de energia na forma de calor e ...... litros de gás carbônico.
(A) 401,7 - 24,4.
(B) 803,4 - 48,8.
(C) 803,4 - 24,4.
(D) 1366,8 - 48,8.
(E) 1366,8 - 24,4.
11. A Lei de Hess, elaborada pelo químico suíço Germain Henry Hess em 1840, afirma, em terminologia moderna, que a variação de entalpia de uma reação química depende apenas dos reagentes de partida e dos produtos finais, e não depende do número de etapas ou intermediários necessários para a conversão dos primeiros nos últimos.
A respeito da Lei de Hess, considere as seguintes afirmações.
I - O metabolismo de um mol de glicose no organismo, formando gás carbônico e água, e a combustão de um mol de glicose num calorímetro liberam a mesma quantidade de calor.
II - Se numa reação de isomerização o conteúdo de entalpia do produto for inferior ao do reagente, a reação será exotérmica.
III - Há sempre a mesma variação de entalpia para uma dada reação de hidrocarbonetos, não importando se a água formada for líquida ou gasosa.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e II.
(D) Apenas II e III.
(E) I, II e III.
12. Quando se adiciona água à "cal viva", forma-se a "cal extinta", de acordo com a reação abaixo.
CaO(s) + H2O(l) ---> Ca(OH)2(s) DH = -236 kcal.mol-1
Se 5,6 g de cal viva forem adicionadas a 1 kg de água, inicialmente a 20 ºC, a temperatura final da água com cal, sabendo-se que o calor específico da água é de 1 cal g-1 (ºC)-1, será de aproximadamente:
(A) 23,6 ºC.
(B) 33,6 ºC.
(C) 43,6 ºC.
(D) 53,6 ºC.
(E) 63,6 ºC.
13. Todos os fatores citados influem no DH de uma reação química, exceto:
(A) quantidade (massa usada) dos reagentes.
(B) fase de agregação dos reagentes e produtos.
(C) forma alotrópica dos reagentes e produtos.
(D) temperatura na qual se dá a reação.
(E) superfície de contato dos reagentes.
14. Conhecendo-se a equação termoquímica:
1CH4(g) + 2Cl2(g) ---> 4HCl(g) + CCl4(g) DH = -101 kcal
e as entalpias-padrão de formação: CH4(g) = -18 kcal/mol e CCl4(g) = -31 kcal/mol
pode-se concluir que a entalpia-padrão de formação do HCl(g) é:
(A) -88 kcal/mol.
(B) +88 kcal/mol.
(C) +44 kcal/mol.
(D) -22 kcal/mol.
(E) +22 kcal/mol.
15. Uma das etapas envolvidas na produção de álcool combustível é a fermentação. A equação que representa esta transformação é:
1 C6H12O6 ---->2 C2H5OH + 2CO2
Conhecendo-se os calores de formação da glicose, do gás carbônico e do álcool, respectivamente -302, -94 e -66 kcal/mol, pode-se afirmar que a fermentação ocorre com:
(A) liberação de 18 kcal/mol.
(B) absorção de 18 kcal/mol.
(C) liberação de 142 kcal/mol.
(D) absorção de 142 kcal/mol.
(E) variação energética nula.
16. A equação para a combustão do gás acetileno, C2H4, é:
1 C2H4(g) + 3 O2(g) ----> 2 CO2(g) + 2 H2O(g) DHº = -337 kcal.
Assumindo 70% da eficiência quantos gramas de água a 20 ºC podem ser aquecidos até 90 ºC, pela combustão de 11,2 litros de gás acetileno, medidos nas condições normais de temperatura e pressão?
(calor específico da água = 1 cal/ ºC g)
(A) 3370.
(B) 1685.
(C) 60,17.
(D) 24,07.
(E) 8,00.
17. De acordo com o gráfico,
a variação de entalpia na reação NH3(g)
+ HCl(g) ----> NH4Cl(s) é:11. A Lei de Hess, elaborada pelo químico suíço Germain Henry Hess em 1840, afirma, em terminologia moderna, que a variação de entalpia de uma reação química depende apenas dos reagentes de partida e dos produtos finais, e não depende do número de etapas ou intermediários necessários para a conversão dos primeiros nos últimos.
A respeito da Lei de Hess, considere as seguintes afirmações.
I - O metabolismo de um mol de glicose no organismo, formando gás carbônico e água, e a combustão de um mol de glicose num calorímetro liberam a mesma quantidade de calor.
II - Se numa reação de isomerização o conteúdo de entalpia do produto for inferior ao do reagente, a reação será exotérmica.
III - Há sempre a mesma variação de entalpia para uma dada reação de hidrocarbonetos, não importando se a água formada for líquida ou gasosa.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e II.
(D) Apenas II e III.
(E) I, II e III.
12. Quando se adiciona água à "cal viva", forma-se a "cal extinta", de acordo com a reação abaixo.
CaO(s) + H2O(l) ---> Ca(OH)2(s) DH = -236 kcal.mol-1
Se 5,6 g de cal viva forem adicionadas a 1 kg de água, inicialmente a 20 ºC, a temperatura final da água com cal, sabendo-se que o calor específico da água é de 1 cal g-1 (ºC)-1, será de aproximadamente:
(A) 23,6 ºC.
(B) 33,6 ºC.
(C) 43,6 ºC.
(D) 53,6 ºC.
(E) 63,6 ºC.
13. Todos os fatores citados influem no DH de uma reação química, exceto:
(A) quantidade (massa usada) dos reagentes.
(B) fase de agregação dos reagentes e produtos.
(C) forma alotrópica dos reagentes e produtos.
(D) temperatura na qual se dá a reação.
(E) superfície de contato dos reagentes.
14. Conhecendo-se a equação termoquímica:
1CH4(g) + 2Cl2(g) ---> 4HCl(g) + CCl4(g) DH = -101 kcal
e as entalpias-padrão de formação: CH4(g) = -18 kcal/mol e CCl4(g) = -31 kcal/mol
pode-se concluir que a entalpia-padrão de formação do HCl(g) é:
(A) -88 kcal/mol.
(B) +88 kcal/mol.
(C) +44 kcal/mol.
(D) -22 kcal/mol.
(E) +22 kcal/mol.
15. Uma das etapas envolvidas na produção de álcool combustível é a fermentação. A equação que representa esta transformação é:
1 C6H12O6 ---->2 C2H5OH + 2CO2
Conhecendo-se os calores de formação da glicose, do gás carbônico e do álcool, respectivamente -302, -94 e -66 kcal/mol, pode-se afirmar que a fermentação ocorre com:
(A) liberação de 18 kcal/mol.
(B) absorção de 18 kcal/mol.
(C) liberação de 142 kcal/mol.
(D) absorção de 142 kcal/mol.
(E) variação energética nula.
16. A equação para a combustão do gás acetileno, C2H4, é:
1 C2H4(g) + 3 O2(g) ----> 2 CO2(g) + 2 H2O(g) DHº = -337 kcal.
Assumindo 70% da eficiência quantos gramas de água a 20 ºC podem ser aquecidos até 90 ºC, pela combustão de 11,2 litros de gás acetileno, medidos nas condições normais de temperatura e pressão?
(calor específico da água = 1 cal/ ºC g)
(A) 3370.
(B) 1685.
(C) 60,17.
(D) 24,07.
(E) 8,00.
17. De acordo com o gráfico,
(A) 75 (exotérmica).
(B) 108 (endotérmica).
(C) 42 (exotérmica).
(D) 86 (endotérmica).
(E) 97 (endotérmica ou exotérmica).
18. O poder calorífico do metano é 55 kJ/g. Qual é o volume (em m3, medido a 32 ºC e 1 atm) de metano que deve ser queimado para produzir 8,8 x 104 kJ de energia?
(Dados: volume molar do gás a 32 ºC e 1 atm = 25 dm3/mol; C=12 e H = 1,0.)
(A) 2,5.
(B) 2,5 x 102.
(C) 8,0 x 102.
(D) 1,6 x 103.
(E) 2,5 x 103.
19. O processo H2O(s) ----> H2O(l), realizado a 1 atm e 273 K, envolve 1440 calorias. O ΔH do congelamento de dois mols de água, nas mesmas condições do processo, é:
(A) + 1440 cal.
(B) + 2000 cal.
(C) - 2000 cal.
(D) - 2880 cal.
(E) + 2880 cal.
20. Com base nas seguintes reações:
2C(s) + 3H2(g) + 1/2O2(g) ----> 1C2H5OH(l) ΔH = -66,0 kcal/mol
1H2(g) + 1/2O2(g) ----> 1H2O(g) ΔH = -58,0 kcal/mol
1C(s) + 1O2(g) ----> 1CO2(g) ΔH = -94,0 kcal/mol
Calcular o calor liberado na queima completa de 50,0 litros de etanol (detanol = 0,80 g/mL).
(A) 2,6 . 105.
(B) 3,2 . 105.
(C) 1,5 . 107.
(D) 2,6 . 102.
(E) 3,2 . 103.
Gabarito:
01.D 02.B 03.C 04.B 05.B 06.B 07.B 08.C 09.E 10.D 11.C 12.C 13.E 14.D 15.A 16.B 17.B 18.A 19.D 20.A







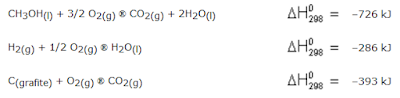




Nenhum comentário:
Postar um comentário